Energie
Teplota
Tání
Tání je přechod pevné látky do kapalného skupenství. U krystalických látek nastává při určité teplotě tání. Většina pevných látek při ní zvětšuje svůj objem, výjimkou je led, bismut, germanium a některé slitiny, které svůj objem snižují. U ledu činí relativní změna objemu asi 9%. Led má při teplotě 0° C hustotu 918 kg m-3. Voda má největší hustotu při teplotě 3,98°C (anomálie vody).
V hloubkách má voda a tedy i zdejší život teplotu 4°C, protože je zde díky tíhové síle voda s největší hustotou. V zimě led plave na vodě a svou nízkou tepelnou vodivostí brání zamrzání vody do větších hloubek. Díky tomu voda v hlubších vodních nádržích zůstává v kapalném skupenství a umožňuje organizmům život, i když je teplota vzduchu nad hladinou hluboko pod bodem mrazu.
Krystalizace
Při krystalizaci nevzniká pevné skupenství okamžitě. Podmínkou je přítomnost krystalizačních jader. Ty vznikají v kapalině po dosažení teploty krystalizace, která je rovna teplotě tání.
Krystalizace kapaliny při dané teplotě a tlaku probíhá tehdy, když je děj provázen poklesem Gibbsovy volné energie G. Volná energie krystalické fáze GS tedy musí být nižší než volná energie fáze amorfní, kapalné GL:
![]()
Krystalizační volná energie se ∆GV se skládá z části entalpické a entropické:
![]()
- uložení molekul kapaliny do krystalické mřížky je provázeno poklesem entalpie (HS < HL), a tedy uvolněním krystalizačního tepla (HS – HL). Toto teplo se za izotermických podmínek musí ze soustavy odvést - veličina HS – HL < 0 , což je pro krystalizační podmínku příznivé.
- entropie kapaliny SL je větší než entropie krystalu SS, neboť soustava v kapalině může nabývat nejrůznějšího vnitřního uspořádání, kdežto v krystalické mřížce jsou molekuly téměř znehybněny a orientovány určitým požadovaným způsobem vůči sousedům. SS – SL < 0, proto výraz –T(Sk – SL) je kladný a zvyšuje ∆GV.
Při teplotě tání ![]() neohraničeného (velkého) krystalu je volná energie tání –∆GV = 0, takže pro ∆Hm a ∆Sm platí:
neohraničeného (velkého) krystalu je volná energie tání –∆GV = 0, takže pro ∆Hm a ∆Sm platí:
![]()
![]()
Za předpokladu, že entalpie a entropie tání jsou prakticky nezávislé na teplotě můžeme ∆GV při teplotě T vyjádřit přibližným vztahem:
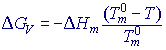
Vytvoření zárodku (krystalizačního jádra) probíhá buď formou homogenní nukleace, kdy vznikají prvotní shluky atomů, které dále rostou, nebo formou heterogenní nukleace, kdy zárodky pevné fáze vznikají na cizích površích v tavenině (stěny nádoby, částice cizích tuhých fází).
Homogenní nukleace
Vytvoření zárodku tvaru koule s poloměrem r je spojené se změnou volné entalpie ∆G spočívající v uvolnění volné energie ∆GV závislé na objemu a zvýšení povrchové energie vznikem nového povrchu (mezifázové rozhraní) závislé na měrné energii fázového rozhraní (povrchovou energii) γ :
![]()
Pevné látky v blízkosti bodu tání mají o 10 až 20% vyšší povrchovou energii než látky v kapalném stavu (přibližně v poměru sublimačního a výparného tepla), povrchové napětí vody při 0°C je γ = 75,6 N/m.
Po překročení kritického poloměru (velikosti) zárodku rk trvale klesá volná entalpie ∆G. Zárodek s poloměrem větším než kritickým (r > rk) bude stabilní a schopen dalšího růstu. Hodnotu rk vypočítáme jako argument pro maximum křivky ∆G:
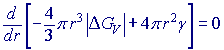
![]()
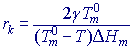
Dosazením rk do vztahu pro výpočet ∆G zjistíme, jak velká bude změna volné entalpie ∆G spojená s vytvořením zárodku kritické velikosti:
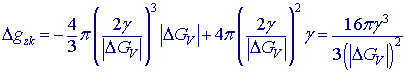
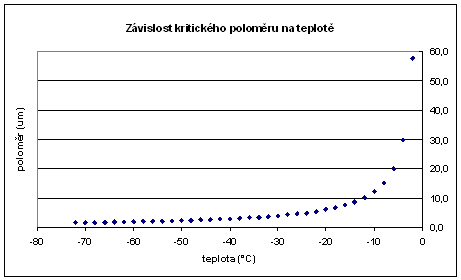
Průběh závislosti kritického poloměru rk na teplotě v případě vody ukazuje následující graf. Z grafu je patrné, že kritická velikost rychle klesá od 0°C, kde matematicky nabývá nekonečna, od -10°C níže pak nabývá hodnoty řádově v jednotkách mikrometrů.
 1
1
Heterogenní nukleace
Zárodky pevné fáze vznikají na cizích površích v tavenině (stěny formy, částice cizích tuhých fází apod.). Heterogenní nukleace je běžnější a energeticky výhodnější než homogenní nukleace. Přibližně k heterogenní nukleaci dochází při přechlazení na teplotu T = 0,98Ttání.
Jako nukleátor působí v tělech organizmů některé makromolekuly, bakterie či prachová zrnka. Různé typy nukleátorů iniciují růst krystalu při různých teplotách, záleží také na jejich celkovém množství ve vzorku. Jakmile se v podchlazeném roztoku objeví přiměřeně velký krystalek, velká část vzorku během zlomku sekundy promrzne.Malá velikost hmyzího těla snižuje pravděpodobnost vzniku zárodečného krystalu. Silně se uplatňují kapilární vlivy při interakci vody s povrchy membrán a makromolekul. Proto se existence v podchlazeném stavu uplatňuje z živočichů především u hmyzu. Pokud je navíc voda vázána v hydratačních obalech molekul (v případě roztoku), je odolnější vůči krystalizaci.
 2
2V přírodě se vyvinuly tři základní strategie přečkávání nízkých teplot:
- Řízené promrzání extracelulární (vněbuněčné) tekutiny. Dochází k němu již při vyšších teplotách – kdy v extracelulární tekutině vznikne větší množství krystalů, které pomalu rostou. Ztrátou molekul vody do krystalu se zahušťuje vnitrobuněčný obsah, který se tím stává odolný proti dalšímu zmrznutí.
Aby krystalizace proběhla již při vyšších teplotách využívají organizmy nukleátory. Buď nukleátory „ tělu vlastní“ (k tomuto účelu dostatečně přizpůsobené krevní proteiny a lipoproteidy), nebo cizí (bakterie, prachová zrnka). Velikost bakterií se pohybuje řádově od desetin do desítek mikrometrů ve shodě s hodnotami kritického poloměru částic.
- Oddalování zamrznutí extracelulární tekutiny, odstraněním nukleátorů z tělních dutin (např. předchozí vyprázdnění střev včetně tzv. nukleačních bakterií). Přítomnost tzv. kryoprotektentů.
- Zbavení se vody a přečkávání nízkých teplot v dehydratovaném stavu se uplatňuje u anhydrobiotických organizmů.
Fázové přeměny (krystalizace a var) v roztoku
Tuhnutí je přechod z kapalné do pevné fáze. Teplota tuhnutí roztoku je nižší než teplota tuhnutí čistého rozpouštědla a závisí na molalitě roztoku. Voda „vázaná“ v hydratačních obalech molekul je odolnější vůči krystalizaci nežli voda „volná.“
Začne-li v podchlazeném roztoku růst krystal ledu, odčerpávají se na jeho stavbu molekuly vody z roztoku a ten se zahušťuje. Ve chvíli, kdy jeho molalita dosáhne hodnoty odpovídající aktuální teplotě, nastává rovnováha mezi krystalem a roztokem. To znamená, že krystal může dále růst teprve po dalším snížení teploty.
K ochraně proti zmrznutí tělních tekutin využívají organizmy látky nazývané kryoprotektanty či antinukleátory. Rozeznáváme prakticky dva základní typy:
Polyoly (polyalkoholy) – látky s nízkou teplotou tuhnutí, snižující ve vysoké koncentraci teplotu tuhnutí výsledného roztoku tělních tekutin (glycerol, polyoly odvozené od jednoduchých cukrů, ethylenglykol).
AFP proteiny (anti-freeze proteins, AFPs) fungující při daleko nižší koncentraci než předchozí skupina, jako antinukleátory - dokáží „obalit“ zárodečný krystal ledu a zabránit mu v dalším růstu.
Vznik ledu v tělech obojživelníků (pdf)
Nukleátory, antinukleátory, kryoprotektanty (pdf)
Zdroje obrázků a grafů :
[1]autor
[2]