Energie
Teplota
Vnitřní energie
Chceme -li ve fyzice popsat vlastnost či stav určitého tělesa, jako základní veličinu použijeme energii. Pokud se těleso pohybuje má kinetickou energii, nachází-li se v silovém poli má potenciální energii. Místo tělesa můžeme ale uvažovat i rostlinu, živočicha, nebo jiný živý organizmus. Kočka lezoucí na strom zvyšuje díky práci svalů svoji potencální energii danou tíhovým polem Země, a při skoku na zem zvyšuje energie kinetickou a její potenciální energie klesá. Oba tyto druhy energie tvoří mechnickou energii.
Kočka ale také může být najezená či vyhladovělá, může jí být zima nebo teplo a tyto vlastnosti stejně jako přeměna energie ve svalovou práci souvisí s energií vnitřní.
Množství, charakter a změny energie příslušející živým organizmům určují jejich tvar, velikost, pohyb a stejně tak i fyziologické děje probíhající v jejich těle. V termodynamice nás budou zajímat zejména změny vnitřní energie.
Příklady dějů v biosféře odpovídající určitým druhům energie a jejich změnám
Kinetická energie tělesa
(translačního, rotačního a kmitavého pohybu)
Pohyb organizmů po zemi, ve vodě a ve vzduchu
Potenciální energie vzájemného působení těles prostřednictvím silových polí (gravitačního, elektrostatického)
Působení Země gravitační silou, a jejím prostřednictvím působení vody a vzduchu tlakovou silou na organizmy
Celková kinetická energie tepelného pohybu částic
(translačního, rotačního a vybračního)
Teplota těla organizmů, závisí na ní intenzita metabolismu (rychlost chemických přeměn)
Celková potenciální energie vzájemného působení částic
Uspořádání makromolekul, skupenství, fluidita membrán aj.
Celková energie elektronů v elektronových obalech
Biochemické přeměny látek, chemické vazby mezi atomy
Celková energie atomových jader
Zůstává stejná
1. termodynamický zákon (zákon zachování energie)
Vnitřní energie tělesa se může změnit, pokud dojde mezi tělesem a okolím k výměně energie ve formě tepla (v důsledku rozdílných teplot) a/nebo práce (vykonané tělesem na okolí nebo okolím na tělese):
![]()
Práce nebo teplo jsou záporné pokud dochází k vykonání práce nebo přenosu tepla na okolí.
Vnitřní energie u živých organizmů
Vnitřní energii získávají organizmy chemickou přeměnou látek a v případě fotosyntetizujících organizmů (rostlin, řas, sinic) navíc také za přispění energie slunečního záření. Energie může být využita k syntéze potřebných látek nebo přeměněna v mechanickou práci svalů umožňující živočichům pohyb. Podle prvního termodynamického zákona se přes všechny změny energie její celkové množství zachovává.Pro syntetické procesy probíhající v buňkách je klíčový zejména zdroj uhlíku, neboť základem organických molekul je vždy uhlíkový řetězec. Podle zdroje uhlíku dělíme organizmy na litotrofní, které získávají uhlík z CO2, a organotrofní, které získávají uhlík z organických sloučenin – jsou tedy závislé na produkci organických látek ostatními organizmy. Kromě toho se organizmy často značně liší ve svých schopnostech využívat různé zdroje ostatních biogenních prvků. Čtyři základní typy získávání energie uvádí následující tabulka:
Změny vnitřní energie
Chemická energie a entalpie
Nejběžnější formou energie, s kterou se v živých systémech setkáváme je chemická energie. Jedná se o část vnitřní energie, tvořenou chemickými vazbami, zprostředkovanými elektronovými obaly jednotlivých atomů. Tato energie se uvolňuje při rozpadu molekul, a je nutná dodat k jejich výstavbě. Průměrná síla vazeb odpovídá teplu, které se při vzniku vazby uvolní nebo spotřebuje v hodnotách veličiny entalpie ∆H. Z takto vyjádřených vazebných energií lze určit reakční tepla. Záporná hodnota ∆H znamená uvolnění tepla při reakci, kladná jeho spotřebování.
Gibbsova energie a entropie
Pro posouzení samovolného průběhu reakce je nutné uvažovat také veličinu entropii ∆S. Zvýšení entropie je provázeno snížením uspořádanosti systému a uvolněním energie. Oba členy jsou zahrnuty v Gibbsově (volné) energii ∆G při konstnantním tlaku a teplotě:
![]()
kde T je termodynamická teplota. Reakční teplo má na hodnotu ∆G zpravidla rozhodující vliv (s teplotou se příliš nemění), vliv entropie je výrazný při vzrůstající teplotě. Samovolný izotermicko (T = konst.) izobarický (p = konst.) děj je provázen poklesem Gibbsovy energie a její minimum určuje rovnováhu.
∆G < 0 exergonická reakce - probíhá samovolně za uvolnění energie, při vysoké absolutní hodnotě ∆G, je v podstatě nezvratná a proběhne úplně
∆G > 0 enedrgonická reakce - probíhá pouze při dodání energie, při vysoké hodnotě je reakční systém stabilní s malou tendencí k reaktivitě.
∆G = 0 systém je v rovnováze
Standardní změny Gibbsovy energie lze dále vyjádřit z hodnot rovnovážné konstanty při reakci K, nebo z hodnot redoxních potenciálů E0
Pro izochoricko-izotermický děj se obdobně užívá Helmholtzova energie, pro kterou obecně platí
![]()
kde ∆U je změna vnitřní energie.
Gibbsova energie v živých organizmech
Vzhledem k tomu, že biochemické reakce v organizmech probíhají při konstantním tlaku a teplotě lze k popisu energetiky reakcí užít Gibbsovu volnou energii a změna entalpie ∆H přibližně odpovídá celkové změně vnitřní energie ∆U. Gibbsova energie udává množství energie uložené ve struktuře biomolekul, která je přeměnitelná za podmínek panujících v organizmu na užitečnou práci.Za situace, kdy jsou reaktanty přítomny v koncentraci 1 mol/l, používá se standardní změny Gibbsovy energie ∆G0. Koncentrace substrátů a metabolitů v organizmech se ovšem pohybuje řádově v 10-3 - 10-5 mol/l, nízká koncentrace se zohledňuje v případě iontů vodíku H+, kdy se za standardní stav považuje prostředí s pH 7,0. Standardní změna Gibbsovy energie v tomto prostředí se pak označuje apostrofem ∆G0´ a lze ji vypočítat z odpovídajících změn rovnovážné konstanty a redoxního potenciálu odpovídající uvedenému prostředí K´ a E0´:
![]()
![]()
Změny ∆G odpovídající skutečným nižším koncentracím ostatních látek většinou nedokážeme určit a proto se spokojujeme se standardními změnami Gibbsovy energie korigovanými pouze na aktuální koncentraci protonů, které představují pouze hrubý odhad.
Následující obrázek představuje hladiny energie vazeb či procesů v biologických systémech. V rámečku jsou makroergické sloučeniny sloužící jako přenašeče energie.
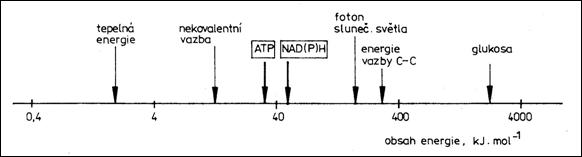 2
2
Endergonické procesy nemohou probíhat samovolně a proto jsou v organizmech spojeny s procesy exergonickými, tak, že výsledná změna je exergonická. Životní pochody např. syntetické reakce, svalová kontrakce, vedení nervového vzruchu nebo aktivní transport látek přes membrány získávají energii spřažením s oxidačními reakcemi. Exergonické procesy tvoří obvykle katabolismus (rozklad, či oxidace), nebo anabolismus spojený s fotosyntézou, ostatní anabolické – syntetické reakce jsou endergonické. Souhrn katabolických a anabolických procesů představuje metabolismus organizmu.
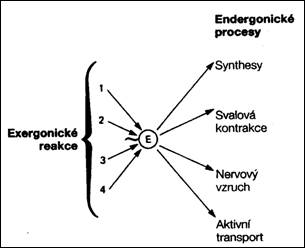 3
3 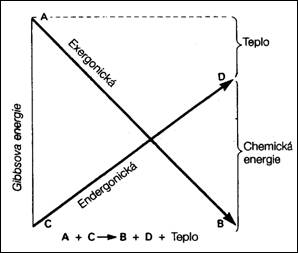 4
4
Přenašeče energie u organizmů
Organizmy využívají k uchování energie speciální vysokoenergetické fosfáty, které hrají roli přenašečů energie mezi endergonickými a exergonickými procesy. Daleko nejvýznamnější je molekula adenosintrifosfátu (ATP). Funguje v buňce jako univerzální přenašeč energie. Jeho klíčové postavení v metabolismu buňky ilustruje následující obrázek. ATP je produktem glykolýzy, dýchacího řetězce a jeho prostřednictvím i oxidace mastných kyselin a citrátového cyklu. ATP je dále využit k chemické, osmotické a mechanické práci tedy endergonickým procesům. Díky jeho výlučnosti je energie uvolněná při přeměně ATP v ADP (adenosindifosfát) brána jakou jednotka energie v biologických systémech.
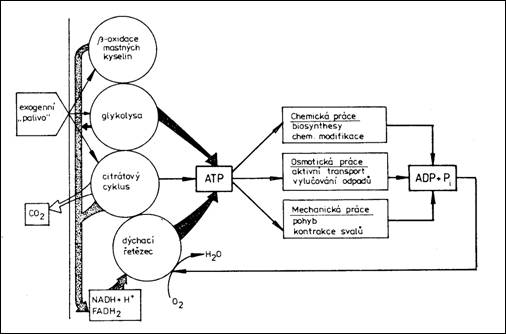 5
5
Jaká je role ATP v buňce? Kolik ATP vyrobí lidské tělo za den?
Další vysokoenergetické fosfáty v živých systémech uvádí následující tabulka:
Organický fosfát
|
∆G0´ (kJ/mol)
|
fosfoenolpyruvát
|
-61,9
|
karbamoylfosfát
|
-51,4
|
1,3 bifosfoglycerát (→ 3
-...)
|
-49,3
|
kreatinfosfát
|
-43,1
|
ATP → ADP + P
|
-30,5
|
ADP → AMP + P
|
-27,6
|
difosfát
|
-27,6
|
glukosa 1 fosfát
|
-20,9
|
fruktosa 6 fosfát
|
-15,9
|
AMP
|
-14,2
|
glukosa 6 fosfát
|
-13,8
|
glycerol 3 fosfát
|
-9,2
|
Zdroje obrázků:
[1] www.greatergracecoffee.com/ interns/gallery.as
[2,5] Vodrážka Z.: Biochemie, Academia, Praha 2002
[3,4] Murray K.: Harperova biochemie, H.+H., Praha 2001
