Energie
Teplota
Fázový přechod
Fázový přechod je skoková změna makroskopických vlastností termodynamického systému (fáze) při změně termodynamické proměnné (např. teploty). Při fázovém přechodu se vždy náhle mění některá makroskopická vlastnost látky, např. hustota, tepelná vodivost, měrná tepelná kapacita atd. Obvykle je přechod mezi fázemi spojen s určitým skupenským teplem, tj. energií, kterou látka musí přijmout či odevzdat, aby k fázovému přechodu mohlo dojít.
Fázové přechody 1. druhu (skupenské) jsou:
- tuhnutí (krystalizace) a tání
- vypařování a kondenzace
- sublimace a desublimace
Skupenské přechody jsou kromě teploty závislé také na tlaku, závislost na obou veličinách je zobrazena fázovým diagramem.
Fázové přechody 2. druhu jsou vznik feromagnetické fáze a piezoelektrických vlastností v materiálech při Curieově teplotě a vznik supravodivosti v kovech a některých dalších látkách při nízké teplotě.
Skupenské fázové přeměny jsou pro organizmy velmi důležité. Při poklesu teploty pod 0°C se organizmy vyrovnávají s problémem vzniku krystalů ledu v těle, které mohou poškodit strukturu buňky.
Tento problém řeší rozmanitými způsoby – endotermií, oddálením vzniku ledu do nižších teplot, či řízeným zamrzáním extracelulárního (vněbuněčného) prostoru.
Vypařování může být v teplých podmínkách jedinou možností udržení nízké tělesné teploty.
 1
1 Fázové rovnováhy
Fázové rovnováhy se ustavují mezi různými fázemi v heterogenních soustavách. Soustava přitom sestává z jedné nebo více složek, přičemž pro zjednodušení většinou nepředpokládáme, že mezi složkami dochází k chemické reakci. Fázové rovnováhy se v heterogenních soustavách řídí Gibbsovým zákonem:
v + f = s + 2
kde v znamená počet stupňů volnosti, f je počet fází a s je počet složek.
Fáze je homogenní část heterogenní soustavy, oddělená od ostatních součástí fázovými rozhraními, na kterých se vlastnosti mění skokem. Fáze může být plynná, kapalná nebo tuhá. V soustavě může být pouze jedna plynná fáze, protože plyny nebo páry se vždy mísí. Kapalných fází může být v soustavě více, pokud se kapaliny spolu nemísí. Rovněž tuhých fází může být v soustavě více. Různé krystalografické modifikace téže látky se považují za různé fáze.
Počet složek je počet chemických individuí, které tvoří soustavu, pokud spolu složky chemicky nereagují. Pokud spolu složky v soustavě mohou reagovat, je počet složek určen jako nejmenší počet chemických individuí, z kterých lze složit celou soustavu.
Počet stupňů volnosti je počet stavových veličin (např. teplota a tlak), které můžeme v určitém rozmezí měnit, aniž bychom tím změnili počet fází.
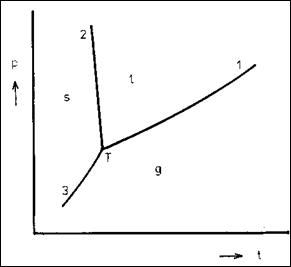
Fázový diagram
Fázový diagram v souřadnicích tlak - teplota představuje oblasti existence jednotlivých fází, v případě vody (led, voda a vodní pára).
Oblasti existence jedné fáze jsou dány plochou a podle Gibbsova zákona má každá samotná fáze v tomto případě dva stupně volnosti. Znamená to, že můžeme měnit tlak i teplotu (v určitých mezích), aniž by se změnil počet fází.
Mezi jednotlivými plochami jsou křivky, které vymezují hranice vzájemné koexistence dvou fází. Všechny křivky jsou souhrnem bodů, kdy vedle sebe existují dvě fáze. Soustavy na těchto křivkách vykazují pouze jeden stupeň volnosti, jak vyplývá s Gibbsova zákona fází a jak je popsáno v předcházející části.
V bodě označeném T vedle sebe existují tři fáze, voda, led a vodní pára. Podle Gibbsova zákona fází vychází pro počet stupňů volnosti v = 0. Znamená to, že nesmíme změnit žádnou stavovou veličinu. Pokud ji změníme, změníme současně i počet fází, tj. snížíme počet fází. Trojný bod je pro každou kapalinu přesně určen teplotou a tlakem.
Křivka 1 představuje křivku vypařování, křivka 2 křivku tání a křivka 3 křivku sublimační. Z fázového diagramu vyplývá, že se zvyšujícím se tlakem, se výrazně zvyšuje teplota varu a již mírněji snižuje teplota tání.
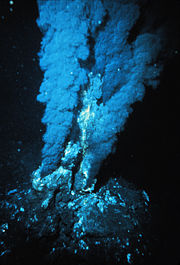
Zvýšení teploty varu umožňuje přežít termofilním bakteriím žijící v oblastech hlubokomořských komínů v oblasti styku tektonických desek v Atlantském oceánu. Zde voda dosahuje až 464°C, tedy v tzv. superkritickém stavu (nad 374°C).
Zdroje obrázků:
[1] http://smoont.com/ice-sculptures/
[2] http://cs.wikipedia.org/wiki/Černý_kuřák
 3
3