Energie
Teplota
-
světelná energie ze Slunce – využitelná fotosyntetizujícími (fototrofními) organizmy jejichž činností vznikají složité organické látky, které jsou zdrojem energie při jejich následné oxidaci pro mnoho dalších organizmů (chemoroganotrofní org.
- energie vznikající oxidací či redukcí chemických prvků zemské kůry (chemolitotrofní organizmy)
V obou případech jde o oxidačně - redukční reakce. Fotosyntetizující organizmy využívají navíc proteinové oxido - redukční soustavy, kde je potřebná energie nutná k proběhnutí reakce získávána ze světelné energie.
Při oxidaci v organizmech je uvolněný elektron postupně předáván z molekuly na molekulu, přičemž se uvolňuje využitelná energie, která je tím větší, čím větší je energetický rozdíl mezi molekulou donoru (primárního zdroje elektronu) a akceptoru (konečného příjemce). Obvykle tento děj probíhá na buněčných membránách (označuje se pak jako dýchání) za vzniku elektrochemického potenciálu na membráně.
 1
1
Typy chemických reakcí
Rozeznáváme základní 4 typy chemických reakcí: redoxní, acidobazické, srážecí a komplexní. Při každé reakci se po určitém čase ustálí rovnováha mezi jednotlivými složkami reakčního systému.

Redoxní reakce, redoxní potenciál E
Redukčně – oxidační (redoxní) reakce jsou reakce, u nichž dochází k přenosu elektronů mezi reakčními složkami, některé atomy se redukují (ztrácejí elektrony), některé se oxidují (získávají elektrony). Každou redoxní reakci lze formálně rozdělit na dvě dílčí poloreakce, z nichž jedna charakterizuje oxidační, a druhá redukční děj. V reakční soustavě se ustaví redoxní rovnováha, kterou charakterizuje redoxní potenciál E, který lze vypočítat z Nernstovy-Petersovy rovnice:
![]()
kde E0 je standardní redoxní potenciál, aox, ared jsou aktivity oxidované a redukované složky, které přibližně odpovídají koncentracím, R je univerzální plynová konstanta, T termodynamická teplota a F je Faradayova konstanta, a z je počet přenášených elektronů. Po dosazení číselných hodnot za R, T, F, nahrazení aktivit koncentracemi a převedení přirozeného logaritmu na dekadický se získá upravený tvar rovnice platný pro laboratorní teplotu 25°C:
![]()
Standardní potenciály E0 jsou tabelovány ve směru poloreakce oxidovaná forma » redukovaná forma. Reakce probíhá ve směru poloreakce, která má větší (kladnější) potenciál E (z praxe platí alespoň o 0,2 V). Pro hrubý odhad zda reakce poběží, stačí často hrubý zjednodušující předpoklad, že E = E0. Samozřejmě pravděpodobnost, že se nezmýlíme, je tím větší, čím je rozdíl potenciálu větší. Prvky jsou seřazeny podle stoupajícího elektrodového potenciálu v tzv. Becketovově řadě.
Li Rb K Cs Fr Ba Ra Sr Ca Na Y Mg Sc Be Al Zr Mn V Ti Ta Zn Cr Nb Ga Fe Cd In Tl Co Ni Sn Pb W H2 Mo Tc Re Bi Cu Os Rh Ru Ag Hg Pd Ir Pt Au
Kov (v kladném oxidačním stavu) stojící vpravo je schopen kov stojící vlevo zoxidovat a sám se redukuje. Je však nutné uvážit i jiné faktory, které mohou způsobit, že daný prvek nereaguje dle schématu např. pasivace kovu u titanu či hliníku, nebo pH reakční směsi.
Při reakcích zahrnujících oxidaci a redukce substrátů je změna volné energie úměrná tendenci reaktantů odevzdávat a přijímat elektrony. Takže kromě možnosti vyjádřit změnu volné energie jako ∆G je rovněž možné ji vyjádřit pomocí redoxního potenciálu E0. Obvykle se srovnává redoxní potenciál daného systému s potenciálem vodíkové elektrody, který se při pH 0 bere jako 0,0V. Pro biologické systémy je však obvyklé používat redox potenciál E0´ měřený při pH 7,0, kdy má vodíková elektroda potenciál -0,42V. Redoxní potenciály systémů mající základní význam v biochemii savců jsou uvedeny v následující tabulce vlevo.
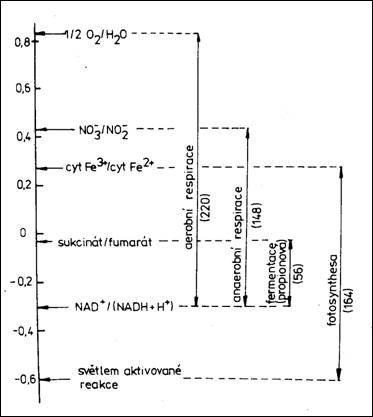
Následující obrázek vpravo pak ilustruje srovnání různých způsobů získávání energie u organizmů podle rozdílu elektrodových potenciálů (na stupnici vlevo) a podle hodnoty Gibbsovy energie (v závorkách).
Systém
|
E0´ (V)
|
|
oxidovaná forma
|
redukovaná forma
|
|
sukcinát
|
α ketoglutarát
|
-0,67
|
H+
|
H2
|
-0,42
|
NAD+
|
NADH
|
-0,32
|
lipoát ox
|
lipoát red
|
-0,29
|
acetacetát
|
ß hydroxybutyrát
|
-0,27
|
pyruvát
|
laktát
|
-0,19
|
oxalacetát
|
malát
|
-0,17
|
flavoprotein ox
|
flavoprotin red
|
-0,12
|
fumarát
|
sukcinát
|
0,03
|
cytochrom b ox
|
cytochtrom b red
|
0,08
|
ubichinon ox
|
ubichinion red
|
0,10
|
cytochrom c ox
|
cytochtrom c red
|
0,22
|
cytochrom a ox
|
cytochtrom a red
|
0,29
|
O2
|
H2O
|
0,82
|
 2
2 Zdroje obrázků:
[1]
[2] Vodrážka Z.: Biochemie, Academia, Praha 2002